Evaluación de los requisitos para el registro de sistemas transdermales genéricos en Latinoamérica
por Julio Salvadori - Gerente de Calidad
Introducción
Las autoridades sanitarias latinoamericanas han avanzado año a año con respecto a los requisitos de registros de productos en general buscando el mejor equilibrio entre la seguridad de sus habitantes, la eficacia de los productos y la realidad económica de cada país.
Es así, que países como México y Brasil (las mayores economías de LatAm), están a la vanguardia con respecto a los requerimientos regulatorios para registro de productos sintéticos.
ANVISA es quién ha dado un paso más allá del resto de los países convirtiéndose en 2016 en miembro de la International Council for Harmonization.
A su vez, el 1ero de Abril de 2020 publicó nuevas regulaciones referidas a los IFAs (ingrediente farmacéutico activo). A través del proceso definido en esta normativa, ANVISA emite un certificado llamado CADIFA (Carta de Adequabilidade do Dossiê de Insumo Farmacêutico Ativo), equivalente al CEP europeo.
Estas dos acciones representaron una revisión completa del escenario regulatorio en Brasil.
Realidad actual de los requisitos regulatorios para el registro de Sistemas de Administración Transdermal en Latinoamérica.
La evolución de los requerimientos regulatorios también ha abarcado al registro de sistemas transdermales genéricos. A su vez, dicho proceso, siempre representó un desafío para los solicitantes y para las autoridades sanitarias, principalmente, por la falta de conocimiento de esta forma farmacéutica por parte de la autoridad, considerando el bajo volumen de solicitudes referentes.
Uno de los puntos claves que siempre trae discusiones es el contenido de droga del producto que se somete a registro, ya que en el caso de productos bioequivalentes, o sea que liberan la misma cantidad de droga por unidad de tiempo (masa/tiempo), no necesariamente tienen igual contenido de droga. De hecho una característica distintiva de la mayoría de los parches desarrollados por Amarin es su mayor eficiencia (igualar el perfil de liberación del producto original con una menor carga total de droga).
Es muy importante realizar la solicitud con el enfoque y claridad adecuada para lograr que las autoridades sanitarias evalúen la documentación de manera correcta, ya que el punto explicado anteriormente es una de las características que diferencia a esta forma farmacéutica de las demás.
Como dijimos previamente, Brasil y México han seguido más de cerca el avance de las regulaciones de los países de alta vigilancia sanitaria.
Es así que, para el caso de registro de sistemas transdermales, han emitido las siguientes regulaciones:
– Cofepris (México): guía de estudios para establecer la intercambiabilidad de medicamentos genéricos en presentación de parches transdérmicos de acción sistémica. 2015 (de carácter vinculante).
– Anvisa: Guia sobre requisitos de qualidade para produtos tópicos e transdérmicos Guia nº 20/2019 – versão 2 (de carácter recomendatorio y no vinculante).
Las mismas, tienen referencia directa a la Guideline on Quality of Transdermal Patches de la European Medicines Agency, Committee for Medicinal Products for Human Use (CHMP).
Si bien algunas otras autoridades latinoamericanas han acompañado la evolución de los requerimientos regulatorios de los países de alta vigilancia sanitaria, en general, al día de hoy todavía existen oportunidades de registro de productos genéricos en algunos países con menores barreras regulatorias.
Haciendo un relevamiento de los sistemas transdermales que se encuentran en el mercado de los 4 países de Latinoamérica con mayor PBI, puede verse que la mayoría son los productos originales, no habiendo una cantidad significativa de registros de genéricos:
Condición | Brasil | Mexico | Colombia | Argentina |
Originales | 7 | 10 | 6 | 7 |
Genéricos | 0 | 3 | 2 | 2 |
Esto demuestra de forma indirecta, el desafío que representa solicitar un registro de un sistema transdermal genérico.
Comparación de los requisitos de registro de productos sintéticos genéricos.
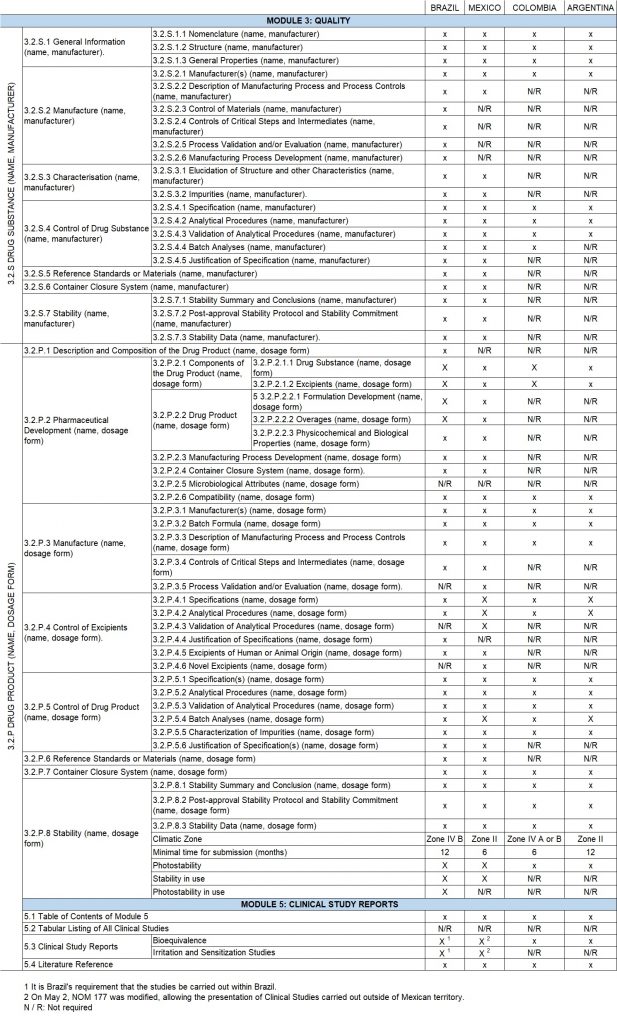
En el siguiente cuadro, se compara los requisitos de aprobación, tomando de base la estructura del CTD para los dos módulos más importantes en el registro de productos genéricos, (Módulo 3 –Calidad-, y el Módulo 5 -Informe de Estudios Clínicos del CTD-), para las 4 mayores economías de Latinoamérica.
Conclusiones
Tanto Brasil como México, las mayores economías de Latinoamérica, han avanzado en los requerimientos regulatorios para el registro de sistemas transdérmicos. Siendo Brasil el país que más ha elevado los estándares para dichos registros, solicitando incluso un certificado para la evaluación de los IFA, acercándose así a los requerimientos de Estados Unidos y Europa.
El registro de sistemas transdermales genéricos es todo un desafío que debe estar abordado teniendo en cuenta las posibilidades de negocios dentro de esos países. Por este motivo las naciones deben balancear la exigencia de sus regulaciones con el tamaño potencial de mercado, para asegurarse a la vez contar con estándares adecuados y permitir el ingreso de productos genéricos que ofrezcan una alternativa normalmente más económica para el paciente y los sistemas de salud.
Por lo expuesto anteriormente, resulta evidente que existen aún oportunidades de registros de productos sintéticos genéricos en países que aún no han hecho una actualización de sus regulaciones.
Suscribite a
#AmarinNews
¡Asóciese con nosotros!
Ofrecemos experiencia y “know how”; y al mismo tiempo, flexibilidad y adaptabilidad a los requerimientos de nuestros clientes.
- info@amarintech.com.ar
- +54 11 4588-6500
- Sanchez 2045 (C1416BQG), Buenos Aires, Argentina.