Validación de Sistemas Computarizados - Guía para preparar el Inventario de Sistemas
Mauro Scasso – Jefe de Aseguramiento de Calidad
Introducción:
En la industria farmacéutica, la validación de sistemas computarizados es esencial para garantizar que los sistemas que impactan en el entorno GxP (Good x Practice) cumplan con los estándares de calidad y regulaciones aplicables. Esta práctica no solo respalda la integridad de los datos, sino que también garantiza la seguridad de los pacientes y la eficacia de los productos, aspectos que son responsabilidad directa de cada fabricante.
¿Qué es un Sistema Computarizado GxP?
Se define como Sistema Computarizado a un sistema que incluye hardware, software, componentes de red, las funciones controladas, el personal involucrado y la documentación asociada.
Un Sistema Computarizado GxP es un sistema que está sujeto a regulaciones GxP (buenas prácticas de fabricación, distribución y otras prácticas aplicables en la industria farmacéutica y de ciencias de la vida), en otras palabras, se trata de su sistema computarizado que de alguna manera se encuentre involucrado en alguna de estas actividades. Estos sistemas deben cumplir con todos los requisitos regulatorios aplicables y garantizar su idoneidad para el uso previsto. Hablamos de una amplia gama de sistemas, como los de gestión de calidad, sistemas de laboratorio, sistemas de manufactura, sistemas de gestión de datos de ensayos clínicos, planificación de recursos de fabricación, etc.
Inventario de sistemas computarizados
Todos los sistemas computarizados que deberemos validar deberán estar listados, es decir incluidos en un inventario.
Un inventario de sistemas es un registro documentado que las empresas reguladas deben mantener, el cual muestra qué sistemas están regulados por GxP. Este inventario proporciona información resumida, como el estado de validación, la propiedad, el impacto, la versión actual y el proveedor para cada sistema. El objetivo es tener un control adecuado sobre los sistemas que apoyan los procesos empresariales, evitando la duplicación y asegurando que la información esté a un nivel adecuado, es decir, a nivel de sistemas y no de elementos individuales de hardware.
Un inventario documentado es fundamental para la gestión efectiva de los sistemas, el cumplimiento de regulaciones y la planificación de su mantenimiento y revisión.
Para la confección del inventario de sistemas computarizados, es fundamental seguir un proceso ordenado y estructurado que permita registrar y gestionar adecuadamente los sistemas con impacto GxP con su nivel de riesgo asociado. A continuación, se detallan los pasos que deben seguirse:
1) IDENTIFICACIÓN DE LOS SISTEMAS COMPUTARIZADOS
Realizar un mapeo exhaustivo de los procesos empresariales y áreas de la compañía para identificar todos los sistemas computarizados en uso.
2) EVALUACIÓN DE IMPACTO GXP (PASO A)
La evaluación de impacto GxP consiste en una evaluación inicial de riesgo que determina el impacto general que el sistema computarizado puede tener en la seguridad del paciente, la calidad del producto y la integridad de los datos.
Para ello, las siguientes preguntas pueden servir como guía:
N° | Preguntas |
1 | ¿El Sistema Computarizado (SC) controla o monitorea directa o indirectamente la calidad del Producto? |
2 | ¿El SC afecta el registro del producto, por ej. Drug Master File, Dossier, etc.? |
3 | ¿El SC genera, gestiona, calcula, almacena datos GxP relevantes cubiertos por medio de una regulación como 21 CFR P11, Anexo 11 EU-GMP, u otra? ¿Utiliza firmas electrónicas? |
4 | ¿El SC indica los materiales a ser utilizados (por ej. Materias primas, materiales de empaque, productos formulados, materiales de ensayos clínicos, etc.? |
5 | ¿Es usado para un RECALL, trazabilidad de los stocks o historial del producto? |
6 | ¿El SC mantiene información del stock, estado del producto, ubicación o vida media del mismo? |
7 | ¿Los datos provenientes del SC son usados para respaldar la liberación del producto? |
8 | ¿Está relacionado con la conciliación, el uso parcial de componentes o lotes divididos? |
9 | ¿Está relacionado con rotulado, codificado de materiales, producto final o componentes del empaque (por ejemplo rótulos de identificación)? |
10 | ¿El SC afecta o impacta sobre la calidad del producto (pureza, potencia, esterilidad, eficacia)? |
11 | ¿El SC es usado para manejar datos de calificación del personal que trabaja en producción, depósito (GMP relacionado) o control de calidad? |
12 | ¿El SC supervisa, o controla la distribución, almacenamiento o transporte de productos o sus condiciones ambientales? |
13 | ¿El SC tiene influencias sobre el mantenimiento y la calibración del equipamiento (manejo de órdenes, certificados, planeamiento de ensayos, límites, |
14 | ¿El SC genera, gestiona, almacena documentos tales como S |
Si al menos una respuesta a las preguntas del Punto A es SI el sistema posee impacto GxP. Luego, se determina el nivel de impacto.
Determinación del Nivel de Impacto GxP
Esta evaluación busca determinar el nivel de impacto de un Sistema GxP, en la cual se tiene en cuenta la complejidad del proceso y la complejidad, novedad y uso del sistema. El nivel de impacto GxP determina la formalidad y el nivel de documentación necesarios para las etapas subsecuentes.
Para determinar el Nivel de Impacto GxP, se puede emplear la siguiente categorización:
- High: If the system has a direct impact on product quality, patient safety, or data integrity.
Generally, high-impact systems include those that:- Generate, manipulate, or control data supporting regulatory safety and efficacy submissions.
- Control critical parameters or data used at any stage, including preclinical, clinical, development, and manufacturing.
- Control or provide data for product release.
- Control data required for product recalls.
- Control records or notifications of adverse events or complaints.
- Support pharmacovigilance.
- Medium: If the system has a direct impact on regulations but not on product quality, patient safety, or data integrity.
- Low: If the system has an indirect impact on product quality, patient safety, or data integrity.
3) EVALUACIÓN DE LA COMPLEJIDAD DEL SOFTWARE – CATEGORIZACIÓN GAMP (PASO B)
La evaluación de la complejidad del software, en el contexto de la categorización GAMP, se basa en la clasificación de los componentes de software y hardware, donde se considera que existe un riesgo creciente de fallas o defectos a medida que se avanza de software/hardware estándar a software/hardware personalizado.
En general, los productos de software se clasifican en distintas categorías, siendo las categorías del 1 al 5, donde:
Categoría 1: Software de Infraestructura
Son elementos que en conjunto conforman un ambiente integrado que permite ejecutar y dar soporte a distintos servicios y sistemas informáticos.
Estos componentes, son:
- Sistemas Operativos (MS Windows, MacOS, Linux, Unix, etc.).
- Motores de Bases de Datos (SQL, Oracle, Posgre, etc.).
- Lenguajes de Programación.
- Hojas de cálculo y aplicaciones de escritorio (Excel, Word, Outlook etc.).
- Antivirus.
Categoría 3: Sistemas no Configurados
- Incluye sistemas comerciales “Off-the-Shelf” (de estantería):
- Software no configurable.
- Software configurable, sin parametrización específica (utilizado de forma estándar, por defecto).
- Software de cálculo estadístico.
- Sistemas de Adquisición de datos no parametrizables.
Categoría 4: Sistemas Configurados
Sistemas que han sido configurados para adecuarse a las necesidades específicas del proceso o para contar con interfaces con otros sistemas informáticos
Los Sistemas de la Categoría 4, incluyen:
- Sistemas estándar, con funcionalidades parametrizables para cubrir los procesos de negocios del área usuaria.
- Enlatados configurables.
- Sistemas de clase mundial, ampliamente reconocidos en el mercado (LIMS, MES, ERP, etc.).
- Un sistema configurable que se categorice como Categoría 3 por no contar con parametrización específica al que, en algún momento de su ciclo de vida, se le realice configuración, deberá ser recategorizado como Categoría 4.
Categoría 5: Sistemas Personalizados
Incluye los sistemas personalizados, como así también aquellos desarrollados a medida del proceso que atenderán.
La Categoría 5, incluye:
- Sistemas estándar, con funcionalidades parametrizables para cubrir los procesos de negocios del área usuaria, y con desarrollos a medida.
- Desarrollos de Sistemas internamente
- Desarrollos externos o software poco reconocido en la industria (o de otras industrias).
- En resumen, la evaluación de la complejidad del software dentro del marco GAMP implica clasificar el software en una de las categorías basadas en su uso y características.
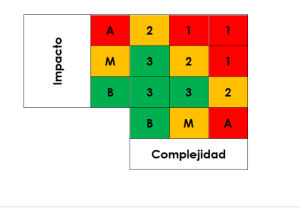
EVALUACION GENERAL DEL IMPACTO DEL SISTEMA
Para realizar la evaluación total de impacto del sistema se consideran las evaluaciones de impacto GxP Punto A y de complejidad del software en el Punto B y se calcula el nivel de riesgo total del sistema de acuerdo con lo definido en la siguiente matriz de riesg
- Clase 1: Riesgo Alto
- Clase 2: Riesgo Medio Medium Risk
- Clase 3: Riesgo Bajo Low Risk
5) DOCUMENTACION Y GESTION DEL INVENTARIO
Por último, deberemos integrar la información recopilada en un registro formal, empleando herramientas electrónicas que permitan una gestión eficiente y actualizaciones periódicas.
Definir un formato estandarizado para el inventario, que incluya secciones para cada uno de los elementos mencionados anteriormente.
Establecer un cronograma para la revisión y actualización del inventario de sistemas, asegurando que cualquier cambio en los sistemas o sus atributos se refleje oportunamente.
6) COMUNICACIÓN Y ENTRENAMIENTO
Es importante asegurar que el personal involucrado en la gestión de los sistemas esté informado sobre la importancia del inventario y los procesos relacionados.
Realizar capacitaciones para garantizar que todos los responsables comprendan cómo documentar y mantener actualizado el inventario de manera eficaz.
CONCLUSION
Con la información obtenida a través de estos pasos, se confecciona un inventario documentado y completo de los sistemas computarizados a validar. Este inventario es clave para garantizar un control efectivo y el cumplimiento de las regulaciones de GxP, contribuyendo a la transparencia, al control del estado de validación y a la planificación estratégica de la gestión de sistemas, facilitando auditorías y evaluaciones internas
Implementar o revisar el inventario de sistemas computarizados es una práctica fundamental para asegurar la calidad en la industria farmacéutica. Aunque el proceso de validación puede ser riguroso, es esencial una correcta preparación, gestión y mantenimiento de este documento.
Suscribite a
#AmarinNews
¡Asóciese con nosotros!
Ofrecemos experiencia y “know how”; y al mismo tiempo, flexibilidad y adaptabilidad a los requerimientos de nuestros clientes.
- info@amarintech.com.ar
- +54 11 4588-6500
- Sanchez 2045 (C1416BQG), Buenos Aires, Argentina.