El ballet de Novartis
Germán Müller – Gerente de Desarrollo de Negocios
Exelon® debería ser presentado en los cursos de marketing farmacéutico como uno de los mejores casos de éxito en lo que a Life cycle managment respecta. En el siguiente artículo, le contamos los motivos
El escenario
Si bien hasta el momento no hay ningún tratamiento que logre curar la demencia o revertir su evolución progresiva, existen numerosas intervenciones disponibles para mejorar la vida de las personas con demencia, sus cuidadores y familias.
Este padecimiento ha sido uno de los principales focos apuntados por la industria farmacéutica en las últimas décadas dentro del marco del Sistema Nervioso Central (SNC).
Complementariamente, el crecimiento demográfico mundial y el constante aumento de la esperanza de vida dan cuenta de que la demencia continuará siendo una de las problemáticas de salud más acuciantes a nivel global como se explica de manera detallada aquí.
En el presente artículo nos centraremos en la estrategia llevada a cabo por Novartis en referencia a la gestión del ciclo de vida de Exelon®, desde el lanzamiento de la Rivastigmina oral en abril del 2000 y hasta la llegada de los parches genéricos de Rivastigmina, lo cual ocurrió entre 2015 y 2019.
Sincronía y ritmo
La rivastigmina como molécula fue patentada en 1985 y empezó a usarse en medicina en 1997. La misma fue desarrollada por Marta Weinstock-Rosin del Departamento de Farmacología de la Universidad Hebrea de Jerusalén y vendida a Novartis por Yissum (la empresa de transferencia de tecnología de la universidad) para el desarrollo comercial.
Posteriormente, el 21st de abril de 2000, Novartis recibió la aprobación de la FDA para Exelon®, cápsulas de Rivastigmina tartrato, indicadas para el tratamiento de la demencia leve a moderada tipo Alzheimer o asociada a la enfermedad de Parkinson.
Mientras la empresa recuperaba sus años de inversión en este desarrollo al ritmo de ventas crecientes, ya estaba enfocada en el próximo paso para adelantarse a la erosión de valor que atravesaría el mercado con la inevitable llegada de los productos genéricos.
The cornerstone of this strategy was given by the development of a Rivastigmine patch, which would be supported by a large and solid clinical trial, which leads to the FDA approval of Exelon® Patch on July 6th, 2007. The constant delivery of Exelon® through the patch showed equivalent efficacy at the target dose to the highest doses of capsules but with three times fewer reports of nausea or vomiting. Thus, this product became the first and only transdermal therapy approved to treat all stages of Alzheimer’s.
Given this approval and in light of the advantages offered by the transdermal patch, Novartis then focused on the migration of patients who were being treated with the oral presentation of Exelon® (as well as some substitute molecules, such as Donepezil and Memantine) towards the recently approved transdermal patch.
Para el año 2010, tres de cada cuatro personas tratadas en los Estado Unidos con Rivastigmina, lo hacían a través de la forma farmacéutica transdermal. Esto indica que en menos de tres años Novartis ya había logrado migrar el 75% de las ventas de rivastigmina a la nueva forma farmacéutica, siendo aún la única empresa que ofrecía ambas alternativas.

Finalmente, el 1st de julio de 2010, Sun Pharma anunció el lanzamiento del primer genérico para Exelon® cápsulas en el mercado estadounidense, el cual había sido previamente aprobado por la FDA como ANDA con una certificación del párrafo IV en octubre de 2007.
El mismo día, en Princeton, Nueva Jersey; Sandoz (el brazo de genéricos de Novartis) anunció la introducción de los comprimidos de Rivastigmina tartrato, como genérico autorizado de Exelon®.
A estos lanzamientos los siguió Watson Pharmaceuticals unos días después, informando que, en virtud de un acuerdo con Novartis, comenzaría la comercialización de una versión genérica de Exelon®. Situación que repetirán Dr. Reddy´s y Alembic/Breckenridge en 2011 y 2012 respectivamente.
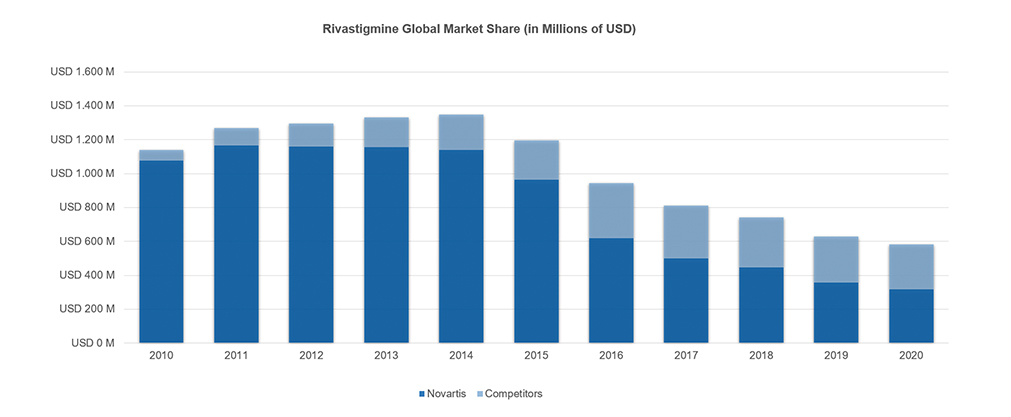
Finalmente, el 31stde agosto del 2015 Alvogen lanzó el primer parche genérico de Rivastigmina al mercado estadounidense en lo que representó un dilatado giro en la trama de la armoniosa obra maestra de Novartis, que a este momento contaba con más del 80% del mercado de Rivastigmina a nivel global, lo cual le representaba cerca de mil millones de dólares en ventas, con la mitad de estas ocurriendo en los Estados Unidos donde su participación del mercado era aún más grande (90%).
Ese fue el comienzo de una fuerte penetración de productos genéricos al mercado de Rivastigmina, la que se complementaría entre los años 2018 y 2019 con el ingreso de nuevos parches genéricos (Mylan, Amneal, Zydus, Breckenridge), llevando las ventas totales para esta molécula a una quinta parte de su valor en el transcurso de 5 años. Descendiendo así del máximo histórico de ventas logrado en los EEUU en el año 2014 con casi USD 650, a una facturación en torno a los USD 120 M para el año 2020, sobre el cual Novartis aún poseía casi el 60%.
Actores Principales
Lógicamente existen una multiplicidad de factores que le permitieron a Novartis perpetuarse en el tiempo en su posición de líder dominante en el mercado de Rivastigmina en sus diferentes formas farmacéuticas, pero existen tres que se destacan del resto ya que resultaron ser determinantes.
El primero de ellos es probablemente el más evidente en la industria farmacéutica, ya que se trata de la esencial protección patentaría, factor elemental en un sector de la economía que involucra largos períodos de investigación con una fuerte inversión en I+D.
La primera patente otorgada en referencia a la Rivastigmina, fue en el año 1990 a su inventora, la cual estuvo en vigencia hasta el año 2012, luego de obtener una prórroga de 5 años. La sucedieron una serie de patentes que protegieron a la forma transdermal y el uso de antioxidantes en esta forma farmacéutica. La primera patente de este segundo grupo venció en febrero de 2014 lo cual permitió el ingreso de ciertos parches genéricos que fueron capaces de circunscribir las patentes aún vigentes, cuyo vencimiento se daba en enero del 2019.
El Segundo factor esencial fue el robusto estudio clínico que llevo adelante Novartis para favorecer una rápida y eficiente transición de los pacientes de Rivastigmina Oral a la presentación transdermal, apuntalado fundamentalmente en las ventajas ofrecidas por el parche.
Tanto la eficacia del producto como la preferencia de los cuidadores por el parche transdérmico frente a las cápsulas de rivastigmina se evaluaron en el extenso estudio multinacional denominado IDEAL por sus siglas en inglés (Investigation of transDermal Exelon® in ALzheimers disease). El cual consistió en un n=1195, de 24 semanas de duración, aleatorizado, doble ciego, con doble simulación, controlado con placebo y comparador activo.
Los pacientes que recibieron 24 semanas de tratamiento con el parche transdérmico de rivastigmina en este estudio experimentaron una mejoría significativa en la función cognitiva. Si bien la mejoría en esta función fue comparable a la observada con las cápsulas de rivastigmina, en el tratamiento con parches se reportaron un tercio menos de náuseas y vómitos. Además, la mayoría (>70 %) de los cuidadores prefirió el parche a las cápsulas, principalmente por la facilidad de mantener el tratamiento y la simpleza de uso.
Finalmente, el último factor importante que le permitió a Novartis hacer de Exelon® un caso de éxito, radica en el precio del producto, ya que cuando ocurrió la transición no hubo impacto significativo para los diversos involucrados en lidiar con los costos de esta terapia. Como vimos anteriormente, al momento del lanzamiento del parche por parte de Novartis no había aún competidores en la presentación oral, lo cual hubiera representado cierta presión sobre el precio complejizando la transición a un parche, típicamente más oneroso que las formas orales.
La evaluación del costo del medicamento fue bien abordada por Novartis en el mencionado estudio. Un análisis farmacoeconómico realizado desde la perspectiva del Servicio Nacional de Salud (NHS) del Reino Unido y basado en las puntuaciones MMSE de IDEAL estimó que, en relación con la mejor alternativa terapéutica, el costo incremental por la unidad de medida QALY (quality-adjusted life-year) obtenida con el parche de rivastigmina fue £10.579 en comparación con £13.042 para las cápsulas de rivastigmina (año de cotización 2008/9). Se observaron resultados similares cuando el análisis del caso base se basó en el MMSE y en las puntuaciones ADL, con costos incrementales estimados por QALY de £9,114 para el parche de rivastigmina y £13,758 para las cápsulas de rivastigmina versus la mejor alternativa terapéutica. Aunque se requiere información farmacoeconómica adicional, estos datos sugirieron que el parche de rivastigmina podía proporcionar una opción de tratamiento rentable para los pacientes con enfermedad de Alzheimer.
Un comentario final en referencia a los vectores de impacto en este análisis, tiene que ver con la intencional omisión del timing en la ejecución de la estrategia por considerarlo evidente, ya que cualquier retraso que pudiera haber ocurrido en el desarrollo del parche, los estudios clínicos, las aprobaciones de las autoridades sanitarias o la migración de los pacientes del comprimido al parche (entre otros), hubiera generado sin dudas algún desajuste en esta pieza de ballet perfectamente sincronizada.
La evolución
A casi 15 años del lanzamiento de Exelon® transdermal, Luye Pharma anunció que la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido ha concedido la aprobación de comercialización para su fórmula innovadora de un parche Multi-dias de Rivastigmina (Rivastigmina MD) para el tratamiento de demencia moderada asociada con la enfermedad de Alzheimer. El producto había recibido previamente autorización de comercialización para varios países de la UE.
Rivastigmina MD es una innovadora formulación que requiere tan solo de una aplicación dos veces por semana para el tratamiento de la demencia leve a moderada asociada con la enfermedad de Alzheimer, e introduce una opción más a las alternativas existentes: tabletas y parches (de un día de duración).
Amarin está comercializando actualmente un parche diario mejorado, ya que tiene un tamaño y contenido de IFA un 24% menor que el Exelon®, lo cual lo pondera como un producto 131% más eficaz. Adicionalmente, nuestra formulación tiene una vida útil un 50 % más prolongada (24 meses de Exelon® frente a 36 meses del parche de Amarin).
Continuando con la evolución del producto y llevar más innovación al campo de los transdermales, en Amarin también estamos trabajando en un parche de rivastigmina de una semana de duración que aportaría beneficios tanto al paciente como a sus familiares y cuidadores.
Referencias:
- Nagy B, Brennan A, Brandtmuller A, et al. Assessing the cost-effectiveness of the rivastigmine transdermal patch for Alzheimer’s disease in the UK using MMSE- and ADLbased models. Int J Geriatr Psychiatry 2011 May; 26 (5): 483-94
- Winblad B, Cummings J, Andreasen N, et al. A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer’s disease-rivastigmine patch versus capsule. Int J Geriatr Psychiatry 2007 May; 22 (5): 456-67
- Rivastigmine Transdermal Patch A Review of its Use in the Management of Dementia of the Alzheimer’s Type Sohita Dhillon Adis, a Wolters Kluwer business, Auckland, New Zealand
- Therapies for Alzheimer’s disease – Irena Melnikova – www.nature.com/reviews/drugdisc / May 2007 (VOLUME 6)
- https://www.fiercebiotech.com/biotech/fda-approves-novartis-alzheimer-s-patch
- https://www.luye.com/en/info.php?id=323
Suscribite a
#AmarinNews
¡Asóciese con nosotros!
Ofrecemos experiencia y “know how”; y al mismo tiempo, flexibilidad y adaptabilidad a los requerimientos de nuestros clientes.
- info@amarintech.com.ar
- +54 11 4588-6500
- Sanchez 2045 (C1416BQG), Buenos Aires, Argentina.

